Dr.Banu Taşçı Fresko tarafından, kendisine ait www.banutascifresko.com adlı site üzerinden gerçekleştirilen internet ortamındaki faaliyetler kapsamında çerezler kullanılmaktadır.
Çölyak hastalığı

Genetik olarak yatkınlığı olan kimselerde; buğday, arpa, çavdar ve yulaf kaynaklı gluten ve prolaminlere bağlı olarak üst ince bağırsakta (Oniki parmak bağırsağı ve jejunum) gelişen enflamatuar ve otoimmün bir hastalıktır.
Hastaların serumunda glutenin gliadin proteini (anti gliadin antikorlar), doku transglutaminazı (Anti TG2, TG3 ve TG6) ve endomizyuma (anti EMA) (bağırsak kas hücrelerine karşı) karşı bağışıklık yanıtı mevcuttur.
Geçmiş yıllarda çölyak hastalığı nadir görülen bir çocukluk çağı hastalığı olarak kabul edilmekteydi. Günümüzde hem kan testleri hem de ince bağırsak biyopsileri sonucunda çölyak hastalığının 100 ila 300 kişiden birini etkileyebildiği gösterilmiştir; dünya üzerindeki en yaygın besin duyarlıklarından birisidir. Kadınlarda erkeklerden iki kat daha fazla görülür. Son 20-30 senede çölyak hastalığının görülme sıklığı neredeyse 2 katına çıkmıştır. Hasta olanların sadece %20’sine tanı konulduğu, diğerlerinin hastalıklarından haberdar olmadıkları düşünülmektedir. Sahra çölü komşuluğunda yaşayan insanlarda sıklık neredeyse %6’yı bulmaktadır.
Çölyak hastalığı olanların birinci dereceden akrabaların da %15 gibi risk artışı gösterilmiştir. İkizlerde ise bu riski %80’e çıkmaktadır. Hastaların %90’ı HLA-DQ2 (HLA DQA1*05-DQB1*02) pozitif, %10’u ise HLA-DQ8 (HLA DQA1*03-DQB103*02) pozitiftir. Çok az hasta HLA-DQ2-8 negatiftir.
HLA molekülleri akyuvarların üstünde bulunan ve vücudun kendisinden olanla olmayanı ayırmasını sağlayan proteinlerdir. Bu HLA proteinleri dışarıdan gelen bağışıklık sistemini uyarıcı proteinlerle (antijenleri) bağ oluşturur ve onları vücudun hücresel bağışıklık sistemine tanıtırlar.
HLA DQ2 ve DQ8’in yapısı gluten peptidleri ile bağ oluşturmaya çok uygundur. Ancak DQ2 ve DQ8 genleri sağlıklı toplumunda yüzde otuzunda görülebildiği ve HLA DQ2-8 pozitif insanların sadece %2-5’i hasta olduğu için çölyak hastalığının oluşumuna tek başına neden olmaz.
Çölyak hastalığının (ve non çölyak gluten/buğday hassasiyetinin) ortaya çıkmasını
- Sezaryen doğum
- Erken bebeklikte antibiyotik kullanımı
- Bebeklik ve çocuklukta antibiyotik kullanımı
- Anne sütü emme süresi
- Bebeğin ilk glutenle karşılaştığı zaman (6 aydan önce)
- Bebek mamalarının içindeki proteinler
- Bağırsak içi enfeksiyonlar
- Bağırsak florasında değişiklikler/disbiyozis
- Helikobakter pylori, Campylobacter jejuni, pnömokok, tüberküloz , sitomegalovirüs, hepatit B ve C virüs, rotavirüs, adenozvirüs, reovirüs, veya enterovirüs enfeksiyonu geçirmek
- Proton pompası inhibitörü kullanımı
- Toksinler, ağır metaller, aflatoksin
- Kronik stres
- Fazla hijyen altında büyümek
- Fazla katkı maddeli, işlenmiş ürün tüketmek
- Besin endüstrisinde glutenin deamide edilmesi
- Besin endüstrisinde mikrobiyal glutaminaz kullanımının başlanması ve artması gibi pek çok çevresel faktör de neden olabilir.
Çölyak hastalığının klasik bağırsak bulguları: ishal, yağlı dışkılama, kusma ve karın ağrısıdır. Bunların dışında kabızlık, kilo alımı, ağızda aft ve reflü gibi bulgular da görülebilir. Hastaların sadece %17’sinde bu klasik bulgular görülmektedir.
Çölyak hastalığı bağırsak dışı bulguları: vitamin ve mineral eksiklikleri (demir, çinko, magnezyum, selenyum, folik asit, B12 vitamini, E vitamini, K vitamini) ve bunlara bağlı olarak kansızlık, kemik erimesi, kemik ağrısı ve kemik kırıkları, diş minesi değişiklikleri ve gece körlüğü görülebilir. Bakır emilim bozukluğuna bağlı hematolojik ve nörolojik sorunlar, karaciğer enzimlerinde açıklanamayan yükseklik ve coğrafi dil de görülebilir. Kemik erimesi tanı konulmamış orta yaş ve üstü kadınlarda ve ağır bağırsak bulguları olan hastalarda daha yüksektir.
Hastalarda sık olarak pek çok cilt bulgusu olabilir: Dermatitis herpetiformis, atopik dermatit, egzama veya ürtiker.
Çocuklarda ve ergenlerde büyüme hızında yavaşlama ve gecikmiş ergenlik, ayrıca sinovit görülebilir.
Kadınlarda çölyak hastalığı adet düzenini ve üreme sağlığını etkileyebilir, üreme çağındaki kadın hastalarda %12 tekrarlayan düşük görülür.
Küçük bir grup hastada depresyon, kaygı bozukluğu, migren, yürürken dengesizlik (ataksi) ve epilepsi şeklinde nörolojik veya psikiyatrik bulgular görülebilir. Yine bundan daha az bir grup hastada çölyak hastalığının otizm, şizofreni ve kanser oluşumuna neden olduğu düşünülmektedir.
Çölyak hastalığına pek çok otoimmün hastalık eşlik eder; bunların başında Tip I diyabet, Hashimoto hastalığı, otoimmün hepatit ve sedef hastalığı gelir. Pek çok romatolojik hastalığın görülme riski yüksektir (juvenil romatoid artrit, sistemik lupus eritamotozus, ankilozan spondilit, Sjögren hastalığı). Anti TPO düzeyleri pek çok hastada yüksek, ANA hastaların 30’unda pozitiftir. Saptanan tiroid antikorlarının düzeyleri glutensiz beslenme ile düşer.
Çölyak hastalarının kendisinde non Hodgkin lenfoma riski yaklaşık 5 kat, birinci derece yakınlarında yaklaşık 2 kat artmıştır.
Hastaların geçmiş yıllara oranla çok daha kilolu veya obez oldukları görülmektedir (tanı konulmuş hastalarda gluten free hazır ürünleri tüketmenin de bunda katkısı vardır).
Tip I diyabet, IBS , tiroid fonksiyon bozukluğu olan hastalar, Addison hastalığı, lenfoma, ağır D vitamini eksikliği, tekrarlayan düşük, Sjögren hastalığı ve Turner sendromu olan hastaların çölyak hastalığı varlığı için ileri tetkik yapılması önerilir.
Çölyak hastalarına biyopsi yapıldığında üst ince bağırsakta (oniki parmak barsağı ve proksimal Jejunum) bağırsak parmaksı çıkıntı villüslerde küçülme (atrofi) ve bağırsak hücreleri çevresinde hücre infiltrasyonu görülebilir.
Gluten proteinleri, sindirim siteminden geçerken mide, pankreas ve ince bağırsak proteaz enzimleri tarafından tam olarak sindirilmezler; bu hem çölyak hastaları hem de yakınması olmayan sağlıklı insanlar için geçerlidir.
Glutenin tam olmayan sindirim sonucu normalden uzun peptit zincirleri bağırsak mukozasına ulaşır; zonulin sekresyonu ile artmış bağırsak geçirgenliğine neden olur, hücrelerin içinden veya arasından geçerek bağırsağın içini ve dışını birbirinden ayıran epitel hücrelerinin altındaki lamina propriyaya ulaşır. En toksik peptidler alfa gliadin kaynaklıdır.
Bu aşamadan sonra bu peptidler hem doğumsal, hem de edinsel bağışıklık sistemlerini harekete geçirirler. Transglutaminaz normalde hücre içinde bulunan bir enzimdir. Transglutaminaz hücre dışına çıkarak, gluten peptidlerini deamide eder (amid grubunu ayırır); bu hali ile peptidler direkt olarak HLA DQ2 ve DQ8 taşıyan hücrelere bağlanabilir. Bağlanma sonrası hücresel bağışıklık sistemi harekete geçer; çok sayıda enflamatuar kimyasal ortama salınır. Hücresel bağışıklık sisteminin aktivasyonu, B hücrelerinden gliadin, deamine gliadin peptidleri ve transglutaminaza karşı antikor üretimine başlanmasına da neden olur.
Transglutaminazlar normal koşullarda hücre içinde bulunur; enflamasyon varlığında ortama salınır. Transglutaminazlar tarafından deamide edilen gliadin peptidleri bağışıklık sistemini daha çok uyarır, daha immünojeniktir. Anti transglutaminaz antikorlar epitelyal hücre diferansiyasyonunu azaltır, bağırsak parmaksı çıkıntılarına zarar verir, bağırsak geçirgenliğine neden olur, ortama monositleri çekerek enflamasyona neden olur.
Tiroid bezi ve kemiklerde transglutaminaz moleküllerinin bulunması nedeniyle tiroid bezine karşı bağışıklık yanıtının gelişmesine ve kemik erimesine neden olur.
Anti TG2 antikorları beyin damarlarını çevreleyen kasların içinde de bulunmuştur; kan beyin bariyerinde artışa yol açarak beyni enflamasyona açık hale getirdiği düşünülmektedir. Ayrıca bir transglutaminaza karşı gelişen antikorlar diğer transglutaminazlarla reaksiyona girerek nörolojik bulguların ortaya çıkışına neden olabilir.
Bunların dışında genetik yapının (interlökin gen allelerinin) da bazı hastalarda yatkınlığı artırdığı gösterilmiştir.
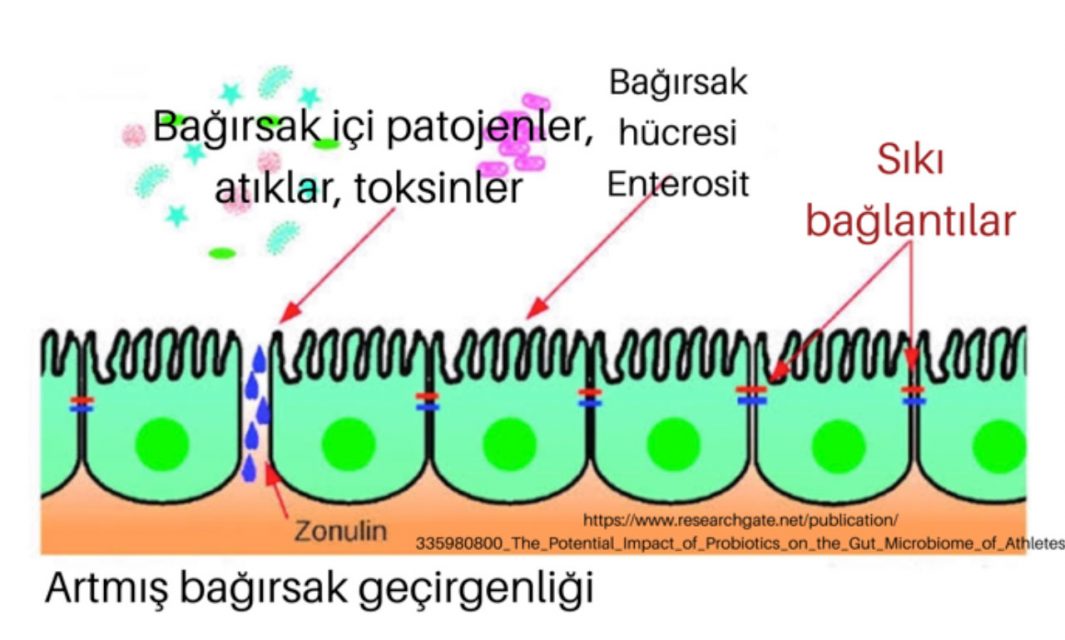
Gliadin sadece çölyak ve non çölyak hassasiyeti olanlarda değil, TÜM insanlarda bağırsak geçirgenliğini artırır; bağırsak mukozasın bulunan kemokin reseptörlerine bağlanarak zonulin sekresyonu ve bağırsak hücreleri arasındaki sıkı bağlantıların açılmasına neden olur. Sıkı bağlantılar açılınca bağırsak içi maddeler, bakteriler, toksinler ve sindirilmemiş besin maddeleri bağırsak çeperini aşarak bağışıklık sistemi ile karşılaşır. Ayrıca dendritik hücrelerden (bağırsağın bağışıklık hücreleri) IL-8 isimli enflamatuvar kimyasalın salınmasına da neden olur; bu etkisi de hastalar ve normaller arasında benzerdir.
Hastaların biyopsisinde yüksek düzeyde mast hücresi infiltrasyonu da saptanmaktadır; özellikle yemek sonrası görülen alerji benzeri bulguların nedeni bu mast hücreleri ve ortama saldıkları histamin oluğu düşünülmektedir.
Çölyak hastaların, tanı konulmadan çok önce başlayan bağırsak bakterilerinin dengesinde bozulma vardır; patojen proteobakter sayıları artmış, yararlı laktobasil sayıları azalmıştır. Ayrıca dışkılarında kandida ve sakaromiçes mantarı düzeyleri normalden yüksektir.
Hastalarda B vitaminleri eksikliğine bağlı homosistein yüksekliği görülebilir.
Dermatitis herpetiformis (Duhring hastalığı)
Çölyak hastalığının cildi tutan şeklidir. Glutene karşı oluşan T hücresi yanıtı sonucu ciltte oluşturduğu enflamasyon nedeniyle ortaya çıkar. Epidermal transglutaminaza (TG3) karşı antikorlar mevcuttur. Çölyak hastalığından daha nadir görülür (yaklaşık 5000 kişiden biri).
Dirseklerde, üst kollarda, kalçalar ve dizlerde (basınç ve travmaya maruz kalan bölgeler) en sık görülür, ama vücudun her yerinde görülebilir.
Çok kaşıntılı, içi su dolu kabarcık öbekleri zamanla yerlerini kızarıklık ve kabuklu egzama benzeri görüntüye bırakır.
Gluten ataksisi
Yürürken ve ayaktayken dengesizlik ve sarhoşluk hissi ile giden ataksi sendromlarının çoğunun nedeni bilinmemektedir (idiopatik ataksi). Hastaların bir kısmında ellerde titreme, ince işleri yaparken hedef tutturamama, sarhoş gibi konuşma (dizartri) veya gözlerde yana bakışta atma hareketi (nistagmus) görülebilmektedir.
Bulgulara gluten nöropatisi eşlik edebilir.
İdiopatik ataksilerin bir kısmında anti-gliadin antikorlar ve beyin transglutaminazı TG6’ye karşı antikorlar pozitif çıkmakta ve hastalar gluten tüketmeyi bırakınca belirgin olarak ataksileri düzelmektedir. Bu hastalarda saptanan anti purkinje antikorların gliadin ile etkileşime geçtiği gösterilmiştir.
Dirençli çölyak hastalığı
Hastaların yaklaşık %10’unda görülür; glütensiz beslenmeye rağmen serum ve bağırsak mukozası değişiklikleri devam eder. 65 yaş üstü, 11 gr altında hemoglobin düzeylerinde, 3.2 gr albümin düzeyleri altında, bağırsak patolojisinde total atrofi varlığı risk faktörleridir.
Hastalardaki en önemli komplikasyon bağırsak lenfoması gelişimidir.
Çölyak hastalarında sütün alfa ve beta kazeinine ve mısırın zein proteinine karşı bağışıklık yanıtı görülebilir; bunun nedeninin kazein, zein ve glutenin peptid yapılarında benzerlik olduğu sanılmaktadır.
Çölyak hastalarının glutensiz diyetle bulgularının gerilemesinde, tam buğdayın nikel düzeylerinin yüksek olmasının katkısı olduğu düşünülmektedir. Glutensiz beslenmeye rağmen mide bağırsak bulguları/yakınmaları ( karın ağrısı, midede yanma, reflü, şişkinlik, bulantı, bağırsak gurultusu, şişkinlik ve sulu dışkılama) devam eden hastaların düşük nikelli beslenmeye geçmeleri önerilmektedir. Aynı çalışmada düşük nikelli beslenmeye geçen hastaların cilt bulguları, baş ağrıları, kas ağrıları, elleri-ayaklarındaki uyuşma, eklem ağrısı, yorgunluk, beyin sisi ve ağız aftları düzelme göstermiştir (Borghini ve ark, 2020).
Çölyak hastalığı tanısı için hastalardan istenmesi gerekli testler:
- Anti-endomizyum IgA ve IgG antikorlar
- Anti-transglutaminaz IgA ve IgG antikorlar
- Anti-deamine (deamide) gliadin IgA ve IgG antikorlar
- Total IgA düzeyi
Çölyak hastalığı olmasına rağmen hastaların %10’unda antikor testleri negatif çıkmaktadır.
Sınırda çıkan antikor değerlerinde ve klinik şüphe olmasına rağmen negatif çıkan hastalarda ince bağırsak biyopsisi yapılmalıdır.
Laboratuvar ve biyopsi sonuçları klinik şüpheyle uyumlu ama kriterleri doldurmazsa, hastadan genetik test istenerek HLA DQ genotiplendirme yapılmalıdır.
Gluten ataksisi düşünülen hastalarda anti TG6 bakılmalıdır (Bu test maalesef Türkiye’de yok).
Bahsedilen antikorların dışında çölyak hastalarında synapsin I, gangliozidler ve kollajene karşı antikor gelişimi görülebilir.
Çölyak hastalarında tip I, III, V ve VI kollajene karşı gelişen antikorların, görülen bağ dokusu problemlerine neden olduğu düşünülmektedir.
Hastalığa eşlik eden pek çok yakınmaya vitamin ve mineral eksiklikleri katkıda bulunur. Özellikle çocuklar, yaşlılar ve nöropsikiyatrik bulgusu olanlarda bu düzeyler daha da önemlidir. Çinko ve E vitamini eksikliği oksidatif strese katkıda bulunur. B vitamini takviyesi sonrasında hem hastaların homosistein düzeyleri düşer, hem de yaşam kaliteleri artar.
Bu vitamin veya mineraller düşük saptandığında, mide bağırsak yakınması olmasa bile, özellikle nedeni bilinmeyen nöropsikiyatrik yakınması olanlarda çölyak hastalığı araştırılmalıdır.
Çölyak hastalığının tedavisi %100 glutensiz beslenmeye geçmek; günde 20 mg’dan fazla gluten tüketmemektir.
Bifidobakteri içeren probiyotikler müsin salgısını artırarak ve sıkı bağlantıları düzelterek glutenin yaptığı zararları bir miktar azaltır.
Hayvanlar arasında da gluteni tolere edemeyen hayvanlar vardır: Irish setter köpekler, atlar, rhesus makakları; bu hayvanlar glutenli besin tükettikleri zaman ishal olurlar.
Referanslar
- Pathogenesis of Celiac Disease and Other Gluten Related Disorders in Wheat and Strategies for Mitigating Them. Sharma N, Bhatia S, Chunduri V, et al. Front Nutr. 2020;7:6. https://pubmed.ncbi.nlm.nih.gov/32118025//
- Modern diagnosis of celiac disease and relevant differential diagnoses in the case of cereal intolerance https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4479435/
- Celiac disease https://pubmed.ncbi.nlm.nih.gov/20040864//
- Autoantibodies in the extraintestinal manifestations of celiac disease Xuechen B Yu, Melanie Uhde, Peter H Green, Armin Alaedini Nutrients 10 (8), 1123, 2018
- Diagnosing coeliac disease: Out with the old and in with the new?. World J Gastroenterol. 2020;26(1):1-10. doi:10.3748/wjg.v26.i1.1/
- The serological diagnosis of coeliac disease – a step forward. Holmes G, Ciacci C. Gastroenterol Hepatol Bed Bench. 2018;11(3):209-215.
- Celiac disease: how complicated can it get? Tjon JM, van Bergen J, Koning F. Immunogenetics. 2010;62(10):641-651. doi:10.1007/s00251-010-0465-9
- Celiac Disease: A Review of Current Concepts in Pathogenesis, Prevention, and Novel Therapies. Jason A. Tye-Din, Heather J. Galipeau and Daniel Agardh. Front. Pediatr., 21 November 2018 https://doi.org/10.3389/fped.2018.003507
- Extra-Intestinal Manifestations of Coeliac Disease in Children: Clinical Features and Mechanisms. Silvia Nardecchia et al. Front. Pediatr., 05 March 2019 | https://doi.org/10.3389/fped.2019.00056/
- Celiac Disease Prevention. Caroline Meijer , Raanan Shamir, Hania Szajewska and Luisa Mearin Front. Pediatr. doi: 10.3389/fped.2018.00368
- Changing Pattern of Childhood Celiac Disease Epidemiology: Contributing Factors. Alina Popp and Markku MäkiFront. Pediatr. doi: 10.3389/fped.2019.0035
- Bittker SS, Bell KR. Potential risk factors for celiac disease in childhood: a case-control epidemiological survey. Clin Exp Gastroenterol. 2019;12:303-319
https://doi.org/10.2147/CEG.S210060/ - Charlesworth RP. Diagnosing coeliac disease: Out with the old and in with the new?. World J Gastroenterol. 2020;26(1):1-10. doi:10.3748/wjg.v26.i1.1
- Antiga E, Maglie R, Quintarelli L, et al. Dermatitis Herpetiformis: Novel Perspectives. Front Immunol. 2019;10:1290. Published 2019 Jun 11. doi:10.3389/fimmu.2019.01290
- Zugna D, Richiardi L, Akre O, Stephansson O, Ludvigsson JF. A nationwide population-based study to determine whether coeliac disease is associated with infertility. Gut. 2010;59(11):1471-1475. doi:10.1136/gut.2010.219030
- Increased Risk for Non-Hodgkin Lymphoma in Individuals With Celiac Disease and a Potential Familial Association 2008 DOI: https://doi.org/10.1053/j.gastro.2008.09.031//
- Botero-López JE, Araya M, Parada A, et al. Micronutrient deficiencies in patients with typical and atypical celiac disease. J Pediatr Gastroenterol Nutr. 2011;53(3):265-270. doi:10.1097/MPG.0b013e3181f988fc
- Yu, X.B.; Uhde, M.; Green, P.H.; Alaedini, A. Autoantibodies in the Extraintestinal Manifestations of Celiac Disease. Nutrients 2018, 10, 1123.
- Celiac Disease and Liver Disorders: From Putative Pathogenesis to Clinical Implications. Hoffmanová et al. Nutrients 2018, 10(7), 892; https://doi.org/10.3390/nu10070892/
- Toğrol RE, Nalbant S, Solmazgül E, et al. The significance of coeliac disease antibodies in patients with ankylosing spondylitis: a case-controlled study. J Int Med Res. 2009;37(1):220-226. doi:10.1177/147323000903700127//
- Lionetti E, Catassi C. The Role of Environmental Factors in the Development of Celiac Disease: What Is New?. Diseases. 2015;3(4):282-293. Published 2015 Oct 27. doi:10.3390/diseases3040282
- Potter MDE, Walker MM, Hancock S, et al. A Serological Diagnosis of Coeliac Disease Is Associated with Osteoporosis in Older Australian Adults. Nutrients. 2018;10(7):849. Published 2018 Jun 29. doi:10.3390/nu10070849
- Qiao SW, Sollid LM, Blumberg RS. Antigen presentation in celiac disease. Curr Opin Immunol. 2009;21(1):111-117. doi:10.1016/j.coi.2009.03.004
- Qiao SW, Bergseng E, Molberg Ø, et al. Antigen presentation to celiac lesion-derived T cells of a 33-mer gliadin peptide naturally formed by gastrointestinal digestion. J Immunol. 2004;173(3):1757-1762. doi:10.4049/jimmunol.173.3.1757
- Stamnaes J, Sollid LM. Celiac disease: Autoimmunity in response to food antigen. Semin Immunol. 2015;27(5):343-352. doi:10.1016/j.smim.2015.11.001
- Gao Y, Kristinsson SY, Goldin LR, Björkholm M, Caporaso NE, Landgren O. Increased risk for non-Hodgkin lymphoma in individuals with celiac disease and a potential familial association. Gastroenterology. 2009;136(1):91-98. doi:10.1053/j.gastro.2008.09.031
- Kahaly GJ, Frommer L, Schuppan D. Celiac Disease and Glandular Autoimmunity. Nutrients. 2018;10(7):814. Published 2018 Jun 25. doi:10.3390/nu10070814
- Laurikka P, Nurminen S, Kivelä L, Kurppa K. Extraintestinal Manifestations of Celiac Disease: Early Detection for Better Long-Term Outcomes. Nutrients. 2018;10(8):1015. Published 2018 Aug 3. doi:10.3390/nu10081015
- Garg K, Agarwal P, Gupta RK, Sitaraman S. Joint Involvement in Children with Celiac Disease. Indian Pediatr. 2017;54(11):946-948. doi:10.1007/s13312-017-1188-x
- Zylberberg HM, Lebwohl B, Green PHR. Celiac Disease-Musculoskeletal Manifestations and Mechanisms in Children to Adults. Curr Osteoporos Rep. 2018;16(6):754-762. doi:10.1007/s11914-018-0488-y
- Volta U, Caio G, Stanghellini V, De Giorgio R. The changing clinical profile of celiac disease: a 15-year experience (1998-2012) in an Italian referral center. BMC Gastroenterol. 2014;14:194. Published 2014 Nov 18. doi:10.1186/s12876-014-0194-x
- Caproni M, Bonciolini V, D’Errico A, Antiga E, Fabbri P. Celiac disease and dermatologic manifestations: many skin clue to unfold gluten-sensitive enteropathy. Gastroenterol Res Pract. 2012;2012:952753. doi:10.1155/2012/952753
- Vici G, Camilletti D, Polzonetti V. Possible Role of Vitamin D in Celiac Disease Onset. Nutrients. 2020;12(4):1051. Published 2020 Apr 10. doi:10.3390/nu12041051
- De Palma G, Nadal I, Medina M, et al. Intestinal dysbiosis and reduced immunoglobulin-coated bacteria associated with coeliac disease in children. BMC Microbiol. 2010;10:63. Published 2010 Feb 24. doi:10.1186/1471-2180-10-63
- Frossi B, De Carli M, Calabrò A. Coeliac Disease and Mast Cells. Int J Mol Sci. 2019;20(14):3400. Published 2019 Jul 11. doi:10.3390/ijms20143400
- Frossi B, Tripodo C, Guarnotta C, et al. Mast cells are associated with the onset and progression of celiac disease. J Allergy Clin Immunol. 2017;139(4):1266-1274.e1. doi:10.1016/j.jaci.2016.08.011
- Wierdsma NJ, van Bokhorst-de van der Schueren MA, Berkenpas M, Mulder CJ, van Bodegraven AA. Vitamin and mineral deficiencies are highly prevalent in newly diagnosed celiac disease patients. Nutrients. 2013;5(10):3975-3992. Published 2013 Sep 30. doi:10.3390/nu5103975
- Halfdanarson TR, Kumar N, Hogan WJ, Murray JA. Copper deficiency in celiac disease. J Clin Gastroenterol. 2009;43(2):162-164. doi:10.1097/MCG.0b013e3181354294
- Coeliac Disease and Mast Cells Int. J. Mol. Sci. 2019, 20(14), 3400; https://doi.org/10.3390/ijms20143400
- Candida albicans in celiac disease: A wolf in sheep’s clothing
- LernerAaron,MatthiasTorsten. https://doi.org/10.1016/j.autrev.2020.102621/
- Adverse Reactions to Wheat or Wheat Components. https://doi.org/10.1111/1541-4337.12475
- https://www.mdpi.com/2072-6643/12/8/2316
- The Revival of the Battle between David and Goliath in the Enteric Viruses and Microbiota Struggle: Potential Implication for Celiac Disease https://doi.org/10.3390/microorganisms7060173/
- McAllister BP, Williams E, Clarke K. A Comprehensive Review of Celiac Disease/Gluten-Sensitive Enteropathies. Clin Rev Allergy Immunol. 2019;57(2):226-243. doi:10.1007/s12016-018-8691-2
- Ferretti G, Bacchetti T, Masciangelo S, Saturni L. Celiac disease, inflammation and oxidative damage: a nutrigenetic approach. Nutrients. 2012;4(4):243-257. doi:10.3390/nu4040243 Murray IA, Daniels I, Coupland K, Smith JA, Long RG. Increased activity and expression of iNOS in human duodenal enterocytes from patients with celiac disease. Am J Physiol Gastrointest Liver Physiol. 2002;283(2):G319-G326. doi:10.1152/ajpgi.00324.2001
- Daniels I, Cavill D, Murray IA, Long RG. Elevated expression of iNOS mRNA and protein in coeliac disease. Clin Chim Acta. 2005;356(1-2):134-142. doi:10.1016/j.cccn.2005.01.029
- Cukrowska B, Sowińska A, Bierła JB, Czarnowska E, Rybak A, Grzybowska-Chlebowczyk U. Intestinal epithelium, intraepithelial lymphocytes and the gut microbiota – Key players in the pathogenesis of celiac disease. World J Gastroenterol. 2017;23(42):7505-7518. doi:10.3748/wjg.v23.i42.7505
- Beckett CG, Dell’Olio D, Shidrawi RG, Rosen-Bronson S, Ciclitira PJ. Gluten-induced nitric oxide and pro-inflammatory cytokine release by cultured coeliac small intestinal biopsies. Eur J Gastroenterol Hepatol. 1999;11(5):529-535. doi:10.1097/00042737-199905000-00011
- Ertekin V, Selimoğlu MA, Türkan Y, Akçay F. Serum nitric oxide levels in children with celiac disease. J Clin Gastroenterol. 2005;39(9):782-785. doi:10.1097/01.mcg.0000177240.67215.da
- Stojiljković V, Todorović A, Radlović N, et al. Antioxidant enzymes, glutathione and lipid peroxidation in peripheral blood of children affected by coeliac disease. Ann Clin Biochem. 2007;44(Pt 6):537-543. doi:10.1258/000456307782268075
- Moos C, Duus KS, Frederiksen P, Heitmann BL, Andersen V. Exposure to the Danish Mandatory Vitamin D Fortification Policy in Prenatal Life and the Risk of Developing Coeliac Disease-The Importance of Season: A Semi Ecological Study. Nutrients. 2020;12(5):1243. Published 2020 Apr 27. doi:10.3390/nu12051243
- Plot L, Amital H. Infectious associations of Celiac disease. Autoimmun Rev. 2009;8(4):316-319. doi:10.1016/j.autrev.2008.10.001
- Unalp-Arida A, Ruhl CE, Choung RS, Brantner TL, Murray JA. Lower Prevalence of Celiac Disease and Gluten-Related Disorders in Persons Living in Southern vs Northern Latitudes of the United States. Gastroenterology. 2017;152(8):1922-1932.e2. doi:10.1053/j.gastro.2017.02.012
- Moretti S, Mrakic-Sposta S, Roncoroni L, et al. Oxidative stress as a biomarker for monitoring treated celiac disease. Clin Transl Gastroenterol. 2018;9(6):157. Published 2018 Jun 8. doi:10.1038/s41424-018-0031-6
- Monguzzi E, Marabini L, Elli L, et al. Gliadin effect on the oxidative balance and DNA damage: An in-vitro, ex-vivo study. Dig Liver Dis. 2019;51(1):47-54. doi:10.1016/j.dld.2018.06.020
- Tetzlaff WF, Meroño T, Menafra M, et al. Markers of inflammation and cardiovascular disease in recently diagnosed celiac disease patients. World J Cardiol. 2017;9(5):448-456. doi:10.4330/wjc.v9.i5.448
- Ferretti G, Bacchetti T, Masciangelo S, Saturni L. Celiac disease, inflammation and oxidative damage: a nutrigenetic approach. Nutrients. 2012;4(4):243-257. doi:10.3390/nu4040243
- Daniels I, Cavill D, Murray IA, Long RG. Elevated expression of iNOS mRNA and protein in coeliac disease. Clin Chim Acta. 2005;356(1-2):134-142. doi:10.1016/j.cccn.2005.01.029
- Cukrowska B, Sowińska A, Bierła JB, Czarnowska E, Rybak A, Grzybowska-Chlebowczyk U. Intestinal epithelium, intraepithelial lymphocytes and the gut microbiota – Key players in the pathogenesis of celiac disease. World J Gastroenterol. 2017;23(42):7505-7518. doi:10.3748/wjg.v23.i42.7505
- Beckett CG, Dell’Olio D, Shidrawi RG, Rosen-Bronson S, Ciclitira PJ. Gluten-induced nitric oxide and pro-inflammatory cytokine release by cultured coeliac small intestinal biopsies. Eur J Gastroenterol Hepatol. 1999;11(5):529-535. doi:10.1097/00042737-199905000-00011
- Ortiz-Sánchez JP, Cabrera-Chávez F, de la Barca AM. Maize prolamins could induce a gluten-like cellular immune response in some celiac disease patients. Nutrients. 2013;5(10):4174-4183. Published 2013 Oct 21. doi:10.3390/nu5104174
- Stojiljković V, Todorović A, Radlović N, et al. Antioxidant enzymes, glutathione and lipid peroxidation in peripheral blood of children affected by coeliac disease. Ann Clin Biochem. 2007;44(Pt 6):537-543. doi:10.1258/000456307782268075
- Gasbarrini G, Rickards O, Martínez-Labarga C, et al. Origin of celiac disease: how old are predisposing haplotypes?. World J Gastroenterol. 2012;18(37):5300-5304. doi:10.3748/wjg.v18.i37.5300
- Abenavoli L, Dastoli S, Bennardo L, et al. The Skin in Celiac Disease Patients: The Other Side of the Coin. Medicina (Kaunas). 2019;55(9):578. Published 2019 Sep 9. doi:10.3390/medicina55090578
- Waszczuk E, Waszczuk K. Gluten, Dysbiosis, and Genetics in Celiac Disease: All Are Important. Dig Dis Sci. 2016;61(9):2761-2762. doi:10.1007/s10620-016-4264-5
- Ungprasert P, Wijarnpreecha K, Tanratana P. Risk of venous thromboembolism in patients with celiac disease: A systematic review and meta-analysis. J Gastroenterol Hepatol. 2016;31(7):1240-1245. doi:10.1111/jgh.13282
- Clappison E, Hadjivassiliou M, Zis P. Psychiatric Manifestations of Coeliac Disease, a Systematic Review and Meta-Analysis. Nutrients. 2020;12(1):142. Published 2020 Jan 4. doi:10.3390/nu12010142
- Lerner A, Arleevskaya M, Schmiedl A, Matthias T. Microbes and Viruses Are Bugging the Gut in Celiac Disease. Are They Friends or Foes? Front Microbiol. 2017 Aug 2;8:1392. doi: 10.3389/fmicb.2017.01392. PMID: 28824555; PMCID: PMC5539691.
- Ou G, Hedberg M, Hörstedt P, Baranov V, Forsberg G, Drobni M, Sandström O, Wai SN, Johansson I, Hammarström ML, Hernell O, Hammarström S. Proximal small intestinal microbiota and identification of rod-shaped bacteria associated with childhood celiac disease. Am J Gastroenterol. 2009 Dec;104(12):3058-67. doi: 10.1038/ajg.2009.524. Epub 2009 Sep 15. PMID: 19755974.

